Thèse de
sciences présentée à la Faculté des sciences de Lyon
pour
obtenir le grade de Docteur de l'Université de Lyon
par ¶
Georges
Clerc
Contribution
à l'étude des triols-1,2,5,
soutenue
le 7 octobre 1954
devant la
commission d'examen :
Prettre,
M., président
Colonge,
J., Mentzer, C., examinateurs
INTRODUCTION
Les triols dont les
fonctions alcool sont en position 1-2-5, 2-5-6, 5-4-7, etc..., c’est-à-dire
les triols qui, d'une manière générale, ont leurs fonctions alcool en
position relative 1-2-5, sont peu connus.
PAUL en étudiant les conditions de rupture du cycle
furannique a donné une méthode qui est la seule présentant un certain
caractère de généralité pour l'obtention de ces composés. Nous la
schématiserons de la façon suivante :
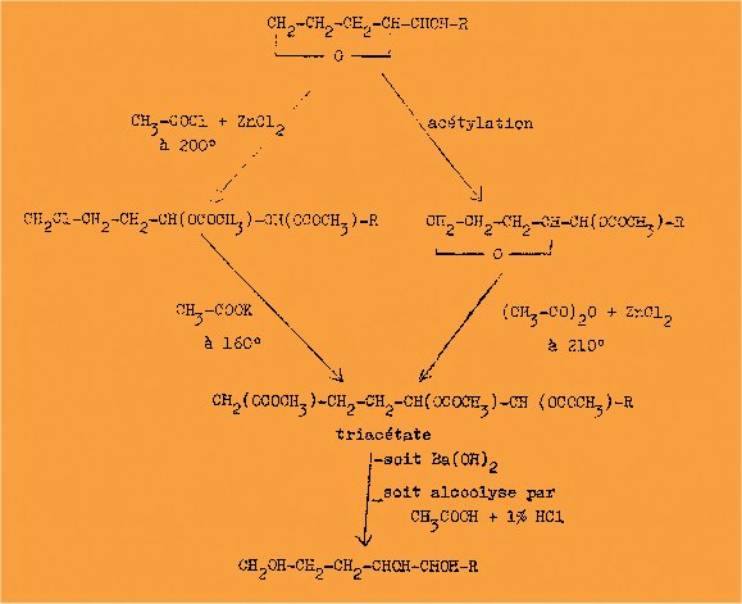
Par ce procédé sont préparés : le pentanetriol 1-2-5,
l'heptanetriol 1-2-5, et le nonanetriol 1-2-5. Le pentanetriol avait déjà été
obtenu par le même auteur a partir des dibromhydrines correspondantes 1-2 et
1-5 (l'obtention de cette dernière est laborieuse) par transformation en
triacétate puis saponification par l'eau de baryte. Enfin plus récemment la
rupture du cycle furannique a été refaite dans les mêmes conditions.
L'hexanetriol 1-2-5 a été préparé depuis longtemps par
MARKOWNIKOW et KABLUKOW puis par TRAUBE et LEHMANN. Pour être complet
signalons que certains auteurs font état avec beaucoup de réserve des modes
de formation d'autres triols de ce type.
Il nous a paru intéressant d'étudier la possibilité de
préparation de ces composés d'une manière plus systématique et plus générale.
En effet tous les triols signalés possèdent une chaîne droite sans
substitution, c'est-à-dire qu'ils ne possèdent que des fonctions alcool
primaire ou secondaire. Nous avons oriente nos recherches dans deux voies
différentes :
1°/ La condensation des alcools acétyléniques vrais
avec les cétones doit conduire à des triols acétyléniques qui, par
hydrogénation, donneront des triols saturés du type 1-2-5:
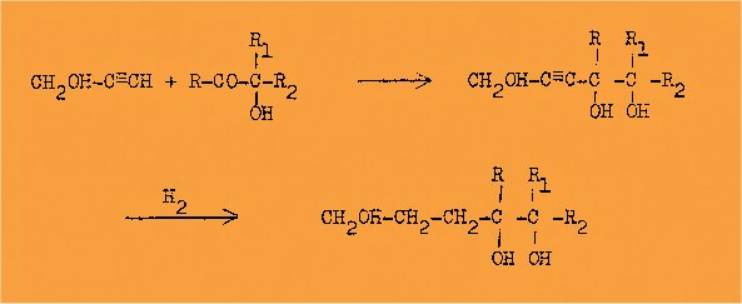
Les triols acétyléniques préparés jusqu'à maintenant
sont en nombre très restreint. Ceux de ce type sont inconnus. Nous n'
insisterons d'ailleurs pas sur cette question car ils sont indistillables et
nous n'avons donc pas pu les purifier.
2°/ La fixation de deux
groupements OH sur les alcools ou les cétones g-éthyléniques :
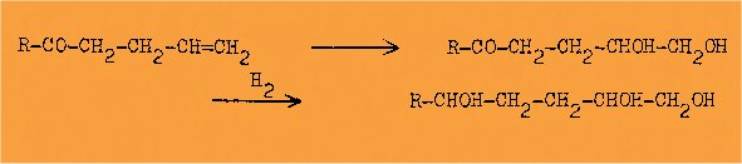
Nous avons ensuite étudié quelques exemples de
déshydratation de ces triols, qui possèdent, de par les positions de leurs
groupements hydroxyles, une forte tendance à se cycliser pour donner, soit un
cycle furannique, soit un cycle pyrannique.
Notre travail sera donc
divisé en trois parties principales:
1ère partie : Condensation
des alcools acétyléniques vrais avec les cétones a-alcools.
2ème partie : Préparation
des triols 1-2-5 à partir des cétones (ou alcools) g-éthyléniques.
3ème partie :
Déshydratation des triols 1-2-5.
Les triols dont les fonctions alcool sont en position
relative 1-2-5, étaitent peu connus jusqu’à maintenant ; en effet, la
littérature ne cite guère que quatre triols de ce type : les
pentane-hexane-, heptane-, nonane-triols 1-2-5. Ils possèdent tous une chaîne
droite.
Nous avons mis au point deux procédés généraux de
préparation de ces composés, qui on fait l’objet chacun d’une partie de ce
travail.
1°/ La condensation des alcools acétyléniques vrais sur
les cétones a-alcools nous a permis de préparer neuf triols, plus ou moins
substitués, encore tous inconnus.
Les cétones a-alcools que nous avons utilisées dans nos condensa, ont été
obtenues par trois précédés généraux de préparation de ces composés :
hydrolyse des cétones a-bromées hydratation des alcools acétyléniques,
méthode de Bouvault et Locquin. Si nous n’avons pas apporté de modification
sensible à ces deux derniers procédés, nous avons par contre fait une étude
systématique et la préparation des cétones
a-bromées et de leur transformation
en a-cétols. Cette étude nous a permis
d’améliorer les rendements et d’adopter une méthode simplifiée.
La condensation a été faite dans l’éther, en présence de
potasse commerciale, qui contient 16% d’eau. Les triols acétyléniques n’ont
pas pu être isolés et ont été hydrogénés directement en triols saturés.
Il nous a été difficile de préparer des dérivés
cristallisés de ces triols. Après de nombreux essais, nous avons obtenus
quatre esters paranitrobenzoïques.
2°/ La transformation des
cétones g-éthyléniques en triols par
hydroxylation de la double liaison puis hydrogénation du cétodiol obtenu,
nous a permis de préparer seulement deux triols, dont l'un était déjà connu.
Pour la préparation des
cétones et alcools g-éthyléniques,
nous nous sommes inspirés des travaux de COLONGE et LAGIER, que nous avons
complétés.
L'hydroxylation a été faite par action de l'acide
hypochloreux puis saponification de la chlorhydrine obtenue en cétodiol. Nous
avons constaté que la présence d'une substitution en a de la fonction cétone provoquait une
cyclisation spontanée de la chlorhydrine en divers produits furaniques. Des
essais faits sur des alcools g-éthyléniques
n'ont pas donné des résultats plus heureux.
Nous avons enfin dans une
troisième partie, étudié la déshydratation de trois triols; nous avons pu
constater qu'ils perdaient facilement une ou deux molécules d'eau en se
cyclisant. La cyclisation conduit de préférence à des composés furaniques. Ce
travail a été rendu difficile du fait que l'on obtient toujours plusieurs
produits de déshydratation ce qui explique, en partie, qu'aucune étude
précise n'avait été faite dans ce domaine.
Mots clefs :
alcool / bouvault / cétodiol / cétol / cétone / chlorhydrine / colonge / condensation /
cyclisation / dibromhydrine / ester / éther / éthylénique / furanique / heptane /
heptanetriol / hexane / hexanetriol / hydrogénation / hydroxylation / hypochloreux /
kablukow / lagier / lehmann / locquin / markownikow / méthode / nonane / nonanetriol /
paranitrobenzoïque / pentane / pentanetriol / préparation / procédé / pyrannique /
saponification / substitution / traube / triacétate / triol / clerc / prettre